Gli Atomi
L'atomo è la più piccola parte di un elemento che conserva le sue proprietà durante una reazione chimica a cui può prendere parte.
La teoria atomica di Dalton
La prima dimostrazione sull'esistenza dell'atomo avvenne nel 1803 da John Dalton. Le sue teorie furono:
- La materia è formata da particelle piccolissime ed invisibili chiamate atomi;
- Gli atomi di uno stesso elemento sono tutti uguali tra loro per dimensione, forma, massa e proprietà;
- Gli atomi di elementi diversi hanno masse diverse;
- Le reazioni chimiche consistono nella separazione e ricombinazione di atomi;
- Nessun atomo di un elemento si trasforma nell'atomo di un altro elemento (non prevede le reazioni nucleari).
Sviluppo del modello atomico
RUTHERFORD'S EXPERIMENTAL DESIGN
La carica elettrica di un atomo è concentrata in una porzione limitata di spazio del nucleo. Nella tavola periodica possiamo trovare dei numeri che indicano il numero atomico, e il numero di massa.
Si definisce numero atomico il numero di protoni presenti nel nucleo e si indica con la lettera Z; in un atomo elettricamente neutro il numero di protoni è uguale al numero di elettroni.
Si definisce numero di massa il numero di protoni + i numeri di neutroni contenuti nel nucleo e si indica con la lettera A.
A=N+Z N=numero di neutroni
Modello atomico di Bohr (1913)
IL modello atomico proposto da Niels Bohr nel 1913, ampliato da Arnold Sommerfeld nel 1916, è la più famosa applicazione della quantizzazione dell'energia, che, insieme all'equazione di Schrödinger sono la base della meccanica quantistica. Egli affermava che:
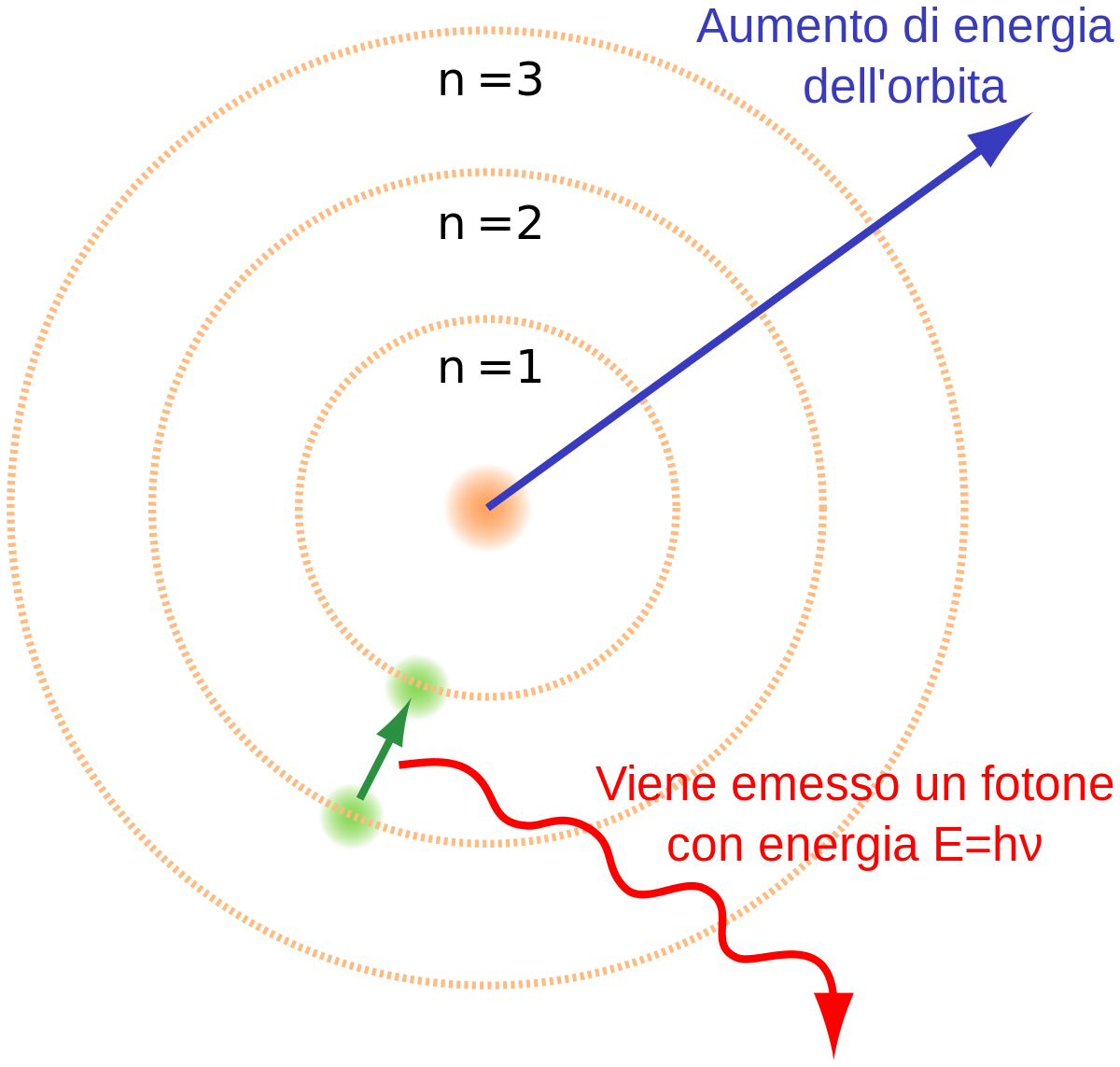
- Gli elettroni si muovono su traiettorie circolari (orbite) ed hanno specifici valori di energia (quanti);
- Si emette luce quando l'elettrone si muove da un livello di energia più alto ad uno più basso.
En=-RH (1/n^2 ) dove n =(numero quantico principale)=1,2,3,... RH= (costante di Rydberg)=2.18*10^-18 J
All'aumentare di n aumenta l'energia dell'elettrone.
Effetto fotoelettrico
Nel 1905 Albert Einstein affermò che la luce è un'onda e un corpuscolo.
Un fotone è una particella di luce.
E=mc^2 λ=h/mc
E=hv
m*c^2=hv=h c/λ
Nel 1924 de Broglie estese a una qualsiasi particella elementare, e all'elettrone in particolare il dualismo onda-corpuscolo enunciato da Einstein.
λ=h/mv dove v= velocità dell'elettrone m= massa dell'elettrone
Principio di indeterminazione di Heisemberg
Werner Karl Heisemberg dimostrò che non è possibile determinare simultaneamente la posizione e la velocità di un elettrone.
Equazione di Schrodinger
Il movimento degli elettroni avviene in tre dimensioni per cui le soluzioni accettabili dell'equazione d'onda derivano dalla combinazione di tre costanti dette "numeri quantici" ed indicati con le lettere n,l,m dove :
n è il numero quantico principale; l è il numero quantico secondario; m è il numero quantico magnetico.
Ogni funzione d'onda caratterizzata da tre numeri quantici viene chiamata orbitale.
Orbitale atomico ψ= f(n,l,m)
Numero quantico principale n
n=1,2,3,4,...
Orbitale atomico ψ= f(n,l,m)
Numero quantico secondario o angolare l
n=1 l=0 l=0 orbitale s n=1 l=0,1 l=1 orbitale p n= 2 l=0,1,2 l=2 orbitale d l=3 orbitale f l=4 orbitale g
Orbitale atomico ψ=f(n,l,m)
Numero quantico magnetico m
m=-l,.......0,........+l
l=0 m=o l=1 m= -1,0,1 l=2 m=-2,-1,0,1,2
L'elettrone è poi caratterizzato da un quarto numero quantico ms legato al moto di spin dell'elettrone ( rotazione intorno all'asse).
Numero quantico di spin= ms(numero fisso ±1/2)
La configurazione elettronica
L'orbitale s ha una forma sferica. L'orbitale p ha la forma di un otto, l'orbitale d ha la forma di un quadrifoglio. La configurazione elettronica è lo studio della disposizione degli elettroni intorno al nucleo.
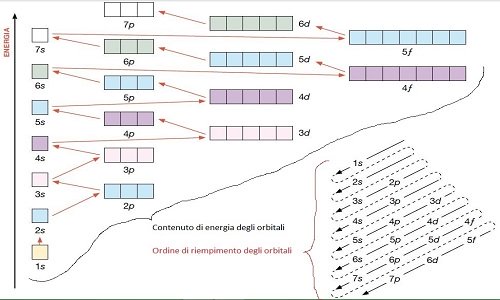
Regola dell'Aufbau
- Un orbitale può contenere un numero massimo di due elettroni (principio di esclusione di Pauli). Se vi sono due elettroni nell'orbitale devono avere un numero quantico di spin ms opposto(+1/2 o -1/2). Un orbitale può anche essere vuoto o contenere un solo elettrone spaiato.
- Nel progressivo riempimento degli orbitali l'elettrone va ad occupare l'orbitale disponibile avente più bassa energia.
- Se vi sono più orbitali con uguale energia (degeneri; ad ex. px,py,pz) la configurazione più stabile (cioè a più bassa energia) è quella che porta alla massima molteplicità, cioè in cui gli elettroni si dispongono con spin parallelo(sempre +1/2 o sempre -1/2) e quindi in orbitali diversi.
Ibridazione
L'ibridizzazione (o ibridazione) è un procedimento di combinazione matematica di un certo numero di orbitali (orbitali s, p, d) con contenuto energetico poco diverso (quindi orbitali di valenza) di uno stesso atomo che permette di ottenere nuovi orbitali ibridi equivalenti (isoenergetici) con i lobi orientati lungo le direzioni dei possibili legami che l'atomo centrale di una o più molecole può formare con altri atomi.
La caratteristica più importante degli orbitali ibridi è il loro "carattere direzionale". Il numero di orbitali ibridi ottenuti è uguale al numero di quelli che vengono combinati, cosicché il numero totale di orbitali di valenza dell'atomo non cambia.
Il processo di ibridazione può essere accompagnato dalla promozione di uno o più elettroni in orbitali più alti; ciò comporta una spesa energetica iniziale da parte dell'atomo che è tuttavia largamente compensata nel momento in cui esso va a legarsi con altri atomi a formare una molecola: l'energia totale del sistema risulta infatti più bassa.
L'ibridizzazione consente di stabilire la forma geometrica di una molecola o di uno ione con il metodo di Gillespie (1957), che è un affinamento della teoria già elaborata nel 1940 da Nevil Sidgwick e Herbert Marcus Powell.
Ibridazione del carbonio
Il C, elemento del quarto gruppo e del secondo periodo, possiede 6 protoni e 6 elettroni disposti negli orbitali nel seguente modo:
ha cioè 2 elettroni spaiati nel livello più esterno. Poiché nei composti organici il C forma 4 legami covalenti, significa che un elettrone dell'orbitale 2s è promosso nell'orbitale 2p e poi si verifica l'ibridazione.
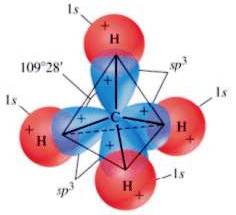
Ibridazione sp3
Si ottiene dal rimescolamento dell'orbitale s con 3 orbitali p;
i 4 orbitali ibridi si dispongono ai vertici di un tetraedro, con angoli di 109.5°.
I legami che formano con gli altri elementi sono di tipo σ, perciò molto forti.
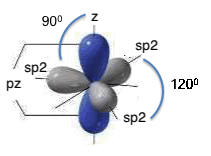
Ibridazione sp2
Dopo la promozione dell'elettrone, un orbitale s si ibrida con 2 orbitali p;
i 3 orbitali ibridi si dispongono sullo stesso piano con angoli di 120°, mentre l'orbitale pnon ibridato si pone perpendicolarmente agli altri 3.
Quando si sovrappone un orbitale p non ibridato di un C con quello di un altro C si ha un legame π, più debole del legame σ; quindi, tra due atomi di C si ha un doppio legame: uno σ e uno π.
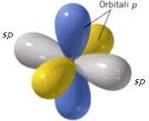
Ibridazione sp
Si ha quando un orbitale s si sovrappone ad un solo orbitale p;
i 2 orbitali ibridi ottenuti si dispongono lungo un asse con un angolo di 180°. Gli orbitali pnon ibridati si pongono perpendicolari tra loro e agli orbitali ibridi.
Gli orbitali ibridi formano due legami σ con altri elementi, mentre tra i due C si ha un triplo legame: uno σ e due π.